アルカロイド

単一のアルカロイドとして初めて単離された物質は、ケシ(Papaver somniferum)から抽出されたモルヒネである(1804年)[1]。
アルカロイド(英: alkaloid)とは、窒素原子を含み、ほとんどの場合塩基性を示す天然由来の有機化合物の総称である。一部のアルカロイドには中性[2]や弱酸性[3]を示すものもある。また、似た構造を有する一部の合成化合物もアルカロイドと呼ばれる[4]。アルカロイドは、炭素、水素、窒素の他酸素や硫黄、その他稀に塩素、臭素、リンといった元素を含む[5]。
アルカロイドは、微生物、真菌、植物、両生類などの動物を含む非常に様々な生物によって生産され、天然物(二次代謝産物とも呼ばれる)の中の一群を成している。多くのアルカロイドは酸塩基抽出によって粗抽出物から精製できる。多くのアルカロイドは他の生物に対して有毒である。しばしば薬理作用を示し、医薬や娯楽のための麻薬としてや、幻覚儀式において使用される。
現在、近似種を含め約数千種があるといわれている。古来からアルカロイドは抽出されてきたが、近代的な研究の元祖は、ドイツの薬剤師ゼルチュネルが1804年(1805年という記述もある)にアヘンから分離抽出したモルフィン、つまりモルヒネであるとされている。
アルカロイドとその他の窒素を含む天然化合物との境界は明確ではない[6]。アミノ酸、ペプチド、タンパク質、ヌクレオチド、核酸、アミン、抗生物質のような化合物は通常アルカロイドとは呼ばれない[2]。環外の位置に窒素を含む天然化合物(メスカリン、セロトニン、ドパミン等)は、通常アルカロイドよりもアミンと呼ばれる[7]。しかし、一部の研究者はアルカロイドをアミンの特別な場合であると考えている[8][9][10]。
目次
1 名称
2 歴史
3 分類
4 性質
5 自然界での分布
5.1 植物
5.2 真菌
5.3 動物
6 抽出
7 生合成
7.1 シッフ塩基の合成
7.2 マンニッヒ反応
8 二量体アルカロイド
9 生物学的役割
10 応用
10.1 医学分野
10.2 農業
10.3 向精神薬としての使用
11 アルカロイドの例
12 脚注
13 参考文献
14 関連項目
名称

「アルカロイド」の概念を導入した文献。
かつては植物塩基(英語: Plant base)という名称も用いられた。この名称が提唱されたのは1818年である。
「アルカロイド」(ドイツ語: Alkaloide)という名称は、ドイツ人化学者Carl F.W. Meissnerによって1819年に導入された。この単語は後期ラテン語の語幹ラテン語: alkali(同じく、「植物の灰」を意味するアラビア語 al-qalwī から来ている)と「〜のような」を意味するギリシャ語の接尾辞-οειδήςに由来する[11]。しかしながら、この用語は1880年代のアルベルト・ラーデンブルクの化学辞典に収録されたO. Jacobsenによる総説記事の出版後になって広く使用されるようになった[12]。
アルカロイドを命名する固有の方法は存在しない[13]。多くの個別の名称は、化合物が単離された種あるいは属名に接尾辞 "ine" を付加して作られている[14]。例えば、アトロピンはオオカミナスビ(ベラドンナ、学名: Atropa belladonna)から単離され、ストリキニーネはマチン(学名: Strychnos nux-vomica L.)の種子から得られる[5]。もし複数のアルカロイドが一つの植物から抽出された場合は、接尾辞の"idine"、"anine"、"aline"、"inine"等がしばしば使われる。また、語幹 "vin" (ニチニチソウ属 (Vinca) 植物から抽出されたことを示す)を含むアルカロイドは少なくとも86種類が存在する[15]。
歴史

ドイツ人化学者フリードリッヒ・ゼルチュルネルはアヘンからモルヒネを初めて単離した。
アルカロイド含有植物は医療ならびに娯楽目的で古代からヒトによって使用されてきた。例えば、少なくとも紀元前2000年頃のメソポタミアでは薬用植物が知られていた[16]。ホメーロスの『オデュッセイア』では、エジプト女王からヘレネーに与えられた贈り物、『無意識の状態へと導く薬剤』(ラテン語: principium somniferum)について記されている[17]。後漢に編纂された中国の本草書である『神農本草経』にはシナマオウやケシの医学的用途について述べられており、明代1596年に李時珍が著わした『本草綱目』は、ヒキガエルの蟾酥など、植物以外をも含めた生薬の知見の集大成となっている。また、コカの葉も古代から南米のインディオによって使用されていた[18]。
アコニチンやツボクラリンといった毒性アルカロイドを含む植物の抽出物は古代から毒矢に使用されていた[16]。
アルカロイドの研究は19世紀に始まった。1804年に、ドイツ人化学者フリードリッヒ・ゼルチュルネルはアヘンから「催眠素」(ラテン語: principium somniferum)を単離し、この物質をギリシア神話の夢の神モルペウスに敬意を表して「morphium」と呼んだ。ドイツ語やその他の中央ヨーロッパ言語では今でもこれがこの薬の名称である。英語やフランス語で使われる「morphine」という用語は、フランス人物理学者ジョセフ・ルイ・ゲイ=リュサックによって命名された。
アルカロイドの化学の発展初期に多大な貢献をしたのは、キニーネ(1820年)およびストリキニーネ(1818年)を発見したフランス人研究者ピエール=ジョセフ・ペルティエおよびジョゼフ・ビヤンネメ・カヴェントゥである。この頃に、キサンチン(1817年)、アトロピン(1819年)、カフェイン(1820年)、コニイン(1827年)、ニコチン(1828年)、コルヒチン(1833年)、スパルテイン(1851年)、コカイン(1860年)を含むその他いくつかのアルカロイドが発見された[19]。
アルカロイドの初の完全合成は1886年にドイツ人化学者アルベルト・ラーデンブルクによって達成された。ラーデンブルクは、2-メチルピリジンとアセトアルデヒドを反応させ、得られた2-プロペニルピリジンをナトリウムで還元することによってコニインを作り出した[20][21]。アルカロイドの化学の発展は20世紀の分光法およびクロマトグラフィー法の出現によって加速され、2008年までに12,000種類を越えるアルカロイドが同定されている[22]。

ヒキガエルから単離されるアルカロイドであるブフォテニンはインドール核を含んでおり、生物内でアミノ酸のトリプトファンから作られる。
分類

ニコチン分子はピリジン環(左)とピロリジン環(右)を含む。
アルカロイドの大半はアミノ基やイミノ基を持つ。
他の多くの天然化合物の分類群と比較して、アルカロイドは大きな構造的多様性を持つことが特徴で、アルカロイドに関する統一的な分類は存在しない[23]。最初の分類法は歴史的にアルカロイドを共通の天然資源(例えば植物種)によって組み合わせてきた。この分類はアルカロイドの化学構造に関する知識の欠如によって正当化されていたが、現在は時代遅れと考えられている[5][24]。より最近の分類は炭素骨格の類似性(例えばインドール様、イソキノリン様、ピリジン様)あるいは生成前駆体(オルニチン、リジン、チロシン、トリプトファン等)に基づいている[5]。しかしながら、これらはどちらとも決めにくい場合には妥協を必要とする[23]。例えば、ニコチンのピリジン断片はニコチンアミドに、ピロリジン部位はオルニチンに由来し[25]、ゆえにどちらの分類群にも割り当てることができる[26]。
アルカロイドはしばしば以下の主要な群に分類される[27]。
- 真正アルカロイド
- 真正アルカロイド (true alkaloid) は、複素環に窒素を含み、アミノ酸に起源を持つ[28]。代表例はアトロピン、ニコチン、モルヒネである。この分類群には、窒素複素環に加えてテルペン(例: エボニン[29])やペプチド(例: エルゴタミン[30])断片を含むアルカロイドもある。また、アミノ酸起源でないにもかかわらず[31]、ピペリジンアルカロイドであるコニインやコニセインもこの分類群に含まれる[32]。
- 不完全アルカロイド
- 不完全アルカロイド (protoalkaloid) は、真正アルカロイドと同様に窒素を含み、アミノ酸に起源を持つが[28]、複素環を持たない。例としてはメスカリン、アドレナリン、エフェドリンがある。
- ポリアミンアルカロイド
プトレシン、スペルミジン、スペルミンの誘導体。- ペプチドおよび環状ペプチドアルカロイド[33]
- 偽アルカロイド
- 偽アルカロイド(擬アルカロイド, プソイドアルカロイド, pseudo-alkaloid)は、窒素源がアミノ酸に由来するのではなく、アンモニア性窒素に由来するアルカロイド様化合物である[34]。この分類群は、テルペン様アルカロイドやステロイド様アルカロイド[35]、カフェイン、テオブロミン、テオフィリンといったプリン様アルカロイドを含む[36]。一部の研究者はエフェドリンやカチノンといった化合物を偽アルカロイドに分類している。これらはアミノ酸であるフェニルアラニンに起源を持つが、窒素原子はアミノ酸からではなくアミノ基転移によって獲得している[36][37]。
一部のアルカロイドは分類群に典型的な炭素骨格を有していない。例えばガランタミンおよびホモアポルフィン類はイソキノリン断片を含んでいないが、一般的にイソキノリンアルカロイドとされる[38]。
単量体アルカロイドの主要な分類を以下の表に示す。
| 分類 | 主要な群 | 主要合成段階 | 例 |
|---|---|---|---|
| 窒素複素環を含むアルカロイド(真正アルカロイド) | |||
ピロリジン誘導体[39] 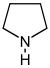 | オルニチンあるいはアルギニン → プトレシン → N-メチルプトレシン → N-メチル-Δ1-ピロリン[40] | クスコヒグリン、ヒグリン、ヒグロリン、スタキドリン[39][41] | |
トロパン誘導体[42]  | アトロピン類 3、6、7位に置換 | オルニチンあるいはアルギニン → プトレシン → N-メチルプトレシン → N-メチル-Δ1-ピロリン[40] | アトロピン、スコポラミン、ヒオスシアミン[39][42][43] |
| コカイン類 2位および3位に置換 | コカイン、エクゴニン[42][44] | ||
ピロリジジン誘導体[45]  | 非エステル | 植物: オルニチンあるいはアルギニン → プトレシン → ホモスペルミジン → レトロネシン[40] | レトロネシン、ヘリオトリジン、ラブルニン[45][46] |
| モノカルボン酸エステル | インジシン、リンデロフィン、サラシン[45] | ||
| 大環状ジエステル | プラチフィリン、トリコデスミン[45] | ||
| 1-アミノピロリジジン類(ロリン類) | 真菌: L-プロリン + L-ホモセリン → N-(3-アミノ-3-カルボキシプロピル)プロリン → ノルロリン[47][48] | ロリン、N-ホルミルロリン、N-アセチルロリン[49] | |
ピペリジン誘導体[50]  | リジン → カダベリン → Δ1-ピペリデイン[51] | セダミン、ロベリン、アナフェリン、ピペリン[32][52] | |
オクタン酸 → コニセイン → コニイン [31] | コニイン、コニセイン[31] | ||
キノリジジン誘導体[53][54] | ルピニン類 | リジン → カダベリン → Δ1-ピペリデイン[55] | ルピニン、ヌファリジン[53] |
シチシン類 | シチシン[53] | ||
スパルテイン類 | スパルテイン、ルパニン、アナヒグリン[53] | ||
マトリン類 | マトリン、オキシマトリン、アロマトリジン[53][56][57] | ||
| オルサニン類 | オルモサニン、ピプタンチン[53][58] | ||
インドリジジン誘導体[59] | リジン → α-アミノアジピン酸のδ-セミアルデヒド → ピペコリン酸 → 1-インドリジジノン[60] | スワインソニン、カスタノスペルミン[61] | |
ピリジン誘導体[62][63] 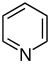 | ピリジンの単純な誘導体 | ニコチン酸 → ジヒドロニコチン酸 → 1,2-ジヒドロピリジン[64] | トリゴネリン、リシニン、アレコリン[62][65] |
| 多環式非縮合ピリジン誘導体 | ニコチン、ノルニコチン、アナバシン、アナタビン[62][65] | ||
| 多環式縮合ピリジン誘導体 | アクチニジン、ゲンチアニン、ペジクリニン[66] | ||
セスキテルペンピリジン誘導体 | ニコチン酸、イソロイシン[10] | エボニン、ヒッポクラテイン、トリプトニン[63][64] | |
イソキノリン誘導体および類縁アルカロイド[67] 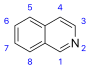 | イソキノリンの単純な誘導体[68] | チロシンあるいはフェニルアラニン → ドーパミンあるいはチラミン(アマリリスアルカロイドの場合)[69][70] | サルソリン、ロホセリン[67][68] |
| 1- ならびに3-イソキノリンの誘導体[71] | N-メチルコリダルジン、ノルオキシヒドラスチニン[71] | ||
| 1- ならびに4-フェニルテトラヒドロイソキノリンの誘導体[68] | クリプトスチリン[68][72] | ||
| 5-ナフチル-イソキノリンの誘導体[73] | アンシストロクラジン[73] | ||
| 1- ならびに2-ベンジル-イソキノリンの誘導体[74] | パパベリン、ラウダノシン、センダベリン | ||
| クラリン類[75] | クラリン、ヤゴニン[75] | ||
| パビン類およびイソパビン類[76] | アルゲモニン[76] | ||
| ベンゾピロコリン類[77] | クリプタウストリン[68] | ||
| プロトベルベリン類[68] | ベルベリン、カナジン、オフィオカルピン、メカンブリジン、コリダリン[78] | ||
| フタリドイソキノリン類[68] | ヒドラスチン、ナルコチン(ノスカルピン)[79] | ||
| スピロベンジルイソキノリン類[68] | フマリシン[76] | ||
イペカクアンハアルカロイド[80] | エメチン、プロトエメチン、イペコシド[80] | ||
| ベンゾフェナントリジン類[68] | サングイナリン、オキシニチジン、コリノロキシン[81] | ||
アポルフィン類[68] | グラウシン、コリジン、リロイデニン[82] | ||
| プロアポルフィン類[68] | プロヌシフェリン、グラジオビン[68][77] | ||
| ホモアポルフィン類[83] | クレイシギニン、ムルチフロラミン[83] | ||
| ホモプロアポルフィン類[83] | ブルボコジン[75] | ||
モルヒネ類[84] | モルヒネ、コデイン、テバイン、シノメニン[85] | ||
| ホモモルヒネ類[86] | クレイシギニン、アンドロシンビン[84] | ||
| トロポロイソキノリン類[68] | イメルブリン[68] | ||
| アゾフルオランテン類[68] | ルフェシン、イメルテイン[87] | ||
アマリリスアルカロイド[88] | リコリン、アンベリン、タゼッチン、ガランタミン、モンタニン[89] | ||
エリスリナアルカロイド[72] | エリソジン、エリトロイジン[72] | ||
フェナントレン誘導体[68] | アテロスペルミニン[68][78] | ||
| プロトピン類[68] | プロトピン、オキソムラミン、コリカビジン[81] | ||
| アリストラクタム[68] | ドリフラビン[68] | ||
オキサゾール誘導体[90] 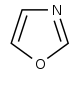 | チロシン → チラミン[91] | アンヌロリン、ハルホルジノール、テキサリン、テキサミン[92] | |
イソオキサゾール誘導体 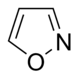 | イボテン酸 → ムッシモール | イボテン酸、ムッシモール | |
チアゾール誘導体[93] 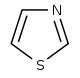 | 1-デオキシ-D-キシルロース-5-リン酸 (DOXP)、チロシン、システイン[94] | ノストシクラミド、チオストレプトン[93][95] | |
キナゾリン誘導体[96]  | 3,4-ジヒドロ-4-キナゾロン誘導体 | アントラニル酸あるいはフェニルアラニンあるいはオルニチン[97] | フェブリフギン[98] |
| 1,4-ジヒドロ-4-キナゾリン誘導体 | グリコリン、アルボリン、グリコスミニン[98] | ||
| ピロリジンおよびピペリジンキナゾリン誘導体 | バジシン(ペガニン)[90] | ||
アクリジン誘導体[90] | アントラニル酸[99] | ルタクリドン、アクロニシン[100][101] | |
キノリン誘導体[102][103] 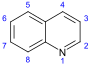 | 2-キノロンおよび4-キノロンのキノリン誘導体の単純な誘導体 | アントラニル酸 → 3-カルボキシキノリン[104] | クスパリン、エキノプシン、エボカルピン[103][105][106] |
| 三環性テルペノイド | フリンデルシンe[103][107] | ||
| フラノキノリン誘導体 | ジクタムニン、ファガリン、スキンミアニン[103][108][109] | ||
キニーネ類 | トリプトファン → トリプタミン → ストリクトシジン(with セコロガニン) → コリナンテアール → シンホニノン [70][104] | キニーネ、キニジン、シンコニン、シンホニジン[107] | |
インドール誘導体[85]  「インドールアルカロイド」も参照 | 非イソプレンインドールアルカロイド | ||
| 単純なインドール誘導体[110] | トリプトファン → トリプタミンあるいは5-ヒドロキシトリプトファン[111] | セロトニン、シロシビン、ジメチルトリプタミン (DMT)、ブフォテニン[112][113] | |
β-カルボリンの単純な誘導体[114] | ハルマン、ハルミン、ハルマリン、エレアグニン[110] | ||
| ピロロインドールアルカロイド[115] | フィゾスチグミン(エセリン)、エテラミン、フィソベニン、エプタスチミン[115] | ||
| セミテルペノイドインドールアルカロイド | |||
麦角アルカロイド[85] | トリプトファン → カノクラビン → アグロクラビン → エリモクラビン → パスパル酸 → リゼルグ酸[115] | エルゴタミン、エルゴバシン、エルゴシン[116] | |
| モノテルペノイドインドールアルカロイド | |||
コリナンセ型アルカロイド[111] | トリプトファン → トリプタミン → ストリクトシジン(with セコロガニン)[111] | アジマリシン、サルパギン、ボバシン、アジュマリン、ヨヒンビン、レセルピン、ミトラギニン[117][118]、ストリキニーネ類(ストリキニーネ、ブルシン、アクアミシン、ボミシン)[119] | |
イボガ型アルカロイド[111] | イボガミン 、イボガイン、ボアカンギン[111] | ||
アスピドスペルマ型アルカロイド[111] | ビンカミン、ビンカアルカロイド、ビンコチン、アスピドスペルミン[120][121] | ||
イミダゾール誘導体[90] 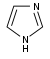 | ヒスチジンから直接[122] | ヒスタミン、ピロカルピン、ピロシン、ステベンシン[90][122] | |
プリン誘導体[123] 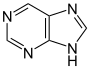 | キサントシン(プリン生合成において形成)→ 7-メチルキサントシン → 7-メチルキサンチン → テオブロミン → カフェイン[70] | カフェイン、テオブロミン、テオフィリン、サキシトキシン[124][125] | |
| 側鎖に窒素を有するアルカロイド(不完全アルカロイド) | |||
β-フェネチルアミン誘導体[77]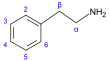 | チロシンあるいはフェニルアラニン → ジオキシフェニルアラニン → ドーパミン → アドレナリンおよびメスカリン → チラミン → 1-フェニルプロパン-1,2-ジオン → カチノン → エフェドリンおよびプソイドエフェドリン[10][37][126] | チラミン、エフェドリン、プソイドエフェドリン、メスカリン、カチノン、カテコールアミン類(アドレナリン、ノルアドレナリン、ドーパミン)[10][127] | |
コルヒチンアルカロイド[128]  | チロシンあるいはフェニルアラニン → ドーパミン → アウツムナリン → コルヒチン [129] | コルヒチン、コルカミン[128] | |
ムスカリン[130]  | グルタミン酸 → 3-ケトグルタミン酸 → ムスカリン(with ピルビン酸)[131] | ムスカリン、アロムスカリン、エピムスカリン、エピアロムスカリン[130] | |
ベンジルアミン[132] 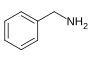 | フェニルアラニンとバリン、ロイシンあるいはイソロイシン[133] | カプサイシン、ジヒドロカプサイシン、ノルジヒドロカプサイシン[132][134] | |
| ポリアミンアルカロイド | |||
プトレシン誘導体[135] | オルニチン → プトレシン → スペルミジン → スペルミン[136] | パウシン[135] | |
スペルミジン誘導体[135] | ルナリン、コドノカルピン[135] | ||
スペルミン誘導体[135] | ベルバセニン、アフェランドリン[135] | ||
| ペプチド(環状ペプチド)アルカロイド | |||
| 13員環ペプチドアルカロイド[33][137] | ヌンムラリンC型 | 異なるアミノ酸から[33] | ヌンムラリンC、ヌンムラリンS[33] |
| ジジフィン型 | ジジフィンA、サチバニンH[33] | ||
| 14員環ペプチドアルカロイド[33][137] | フラグラニン型 | フラグラニン、スクチアニンJ[137] | |
| スクチアニンA型 | スクチアニンA[33] | ||
| インテゲリン型 | インテゲリン、ジスカリンD[137] | ||
| アンフィビンF型 | アンフィビンF、スピナニンA[33] | ||
| アンフィビンB型 | アンフィビンB、ロツシンC[33] | ||
| 15員環ペプチドアルカロイド[137] | ムクロニンA型 | ムクロニンA [30][137] | |
| 疑アルカロイド(テルペンおよびステロイド) | |||
ジテルペン [30] | リコクトニン型 | メバロン酸 → イソペンテニル二リン酸 → ゲラニル二リン酸[138][139] | アコニチン、デルフィニン[30][140] |
ステロイド[141] 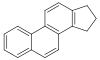 | コレステロール、アルギニン[142] | ソラソジン、ソラニジン、ベラルカミン、バトラコトキシン[143] | |
性質
ほとんどのアルカロイドは分子構造中に酸素を含んでいる。これらの化合物は穏和な条件においては大抵無色の結晶である。ニコチン[144]あるいはコニイン[20] といった酸素を含まないアルカロイドは通常揮発性、無色、油状液体である[145]。ベルベリン(黄色)やサングイナリン(橙色)のように一部のアルカロイドは着色している[145]。
ほとんどのアルカロイドは弱い塩基であるが、一部のアルカロイド、例えばテオブロミンおよびテオフィリンは両性である[146]。ほとんどのアルカロイドは水に対する溶解性が低いが、ジエチルエーテル、クロロホルム、1,2-ジクロロエタンといった有機溶媒には容易に溶解する。しかしながら、カフェインは沸騰水によく溶ける[146]。酸とは、様々な強さで塩を形成する。これらの塩は通常水およびアルコールに可溶でありほとんどの有機溶媒に対する溶解性は低い。例外としては有機溶媒に溶解するスコポラミン臭化水素酸塩や水溶性のキニーネ硫酸塩がある[145]。
アルカロイドは植物体内の各種アミノ酸から生合成され、シュウ酸・リンゴ酸・クエン酸・酢酸・酒石酸などの有機酸の塩の状態で各々の体内に保持されている(例えばクエン酸塩、リンゴ酸塩など)。それが何らかの要因で分解、分離、もしくは抽出されればアルカロイドと呼べる物質になり、摂取した動物の体内に諸影響を及ぼす。
ほとんどのアルカロイドは苦味を有している。植物は、動物から自身を防御するためにこれらの苦味物質(多くは有毒)を生産する能力を進化により獲得したと考えられている。しかし、一方で動物もアルカロイドを解毒する能力を発達させてきた[147]。一部のアルカロイドは、摂取したアルカロイドを解毒できない動物の子孫に発育障害を起こす。特徴的な例はカリフォルニア・コーン・リリー (Veratrum californicum) の葉に存在するシクロパミンである。1950年代の間、コーン・リリーを食べた羊から産まれた子羊の最大25%が重篤な顔面障害を被った。これらの障害は顎の奇形から単眼症に及んだ。数十年の研究の後、1980年代に、奇形の原因となる物質がアルカロイドである11-デオキシジェルビンと同定され、単眼症 (cyclopia) からシクロパミン (サイクロパミン、cyloapmine, cyclopia + amine) と命名された[148]。
自然界での分布
自然界において、アルカロイドは主に植物の同化により生成されているが、他に真菌や両生類などの動物が作り出すものがある。多くの海洋生物もまたアルカロイドを含んでいる[149]。
植物

マチンの木。種子にはストリキニーネおよびブルシンが豊富に含まれている。

乳白色の耳腺分泌物にブフォテニンなどを持つアジアヒキガエル。
様々な生物がアルカロイドを生成している。特に高等植物はおよそ10から25%の種がアルカロイドを含んでいる[150][151]。そのため、以前は「アルカロイド」という語は植物を連想させることが多かった[152]。基本的に植物は、体の中に何種類ものアルカロイドを保持している。例えばケシの実から作られるアヘンには、モルヒネ、コデインなどをはじめとして約20種が含まれる。
同一の植物に含まれるアルカロイドは化学的に近い性質を持つものであることが多い。植物がその体内に保持しているアルカロイドの中で、比較的含有量が多いものは主アルカロイド、それに伴う幾種ものアルカロイドが副アルカロイドと呼ばれる。アルカロイドは主に顕花植物、殊に双子葉類の植物に見出される。体内にアルカロイドを含有する植物としては主に、キンポウゲ科、ケシ科、ナス科、ヒガンバナ科、マメ科、メギ科、ユリ科、トウダイグサ科、ウマノスズクサ科などがある。
植物のアルカロイド含量は通常数パーセント以内で、植物組織に不均一に分布している。植物の種類により、最大濃度となる部位は葉(ヒヨス)、果実あるいは種子(マチン)、根(インドジャボク)、樹皮(キナ属)など様々である[153]。その上、植物の異なる組織がそれぞれ異なるアルカロイドを含んでいる場合もある[154]。
真菌
シビレタケ属 Psilocybeにおけるシロシビンなどが知られる。
動物
動物では両生類のヒキガエル科のカエル(無尾目)の皮膚腺(耳腺)分泌物においてブフォテニンなどが見出される[13]。また、イモリ(有尾目)の1種のファイアサラマンダーはサマンダリンを持つ。
高等動物において重要な役割を果たすアドレナリンおよびセロトニンといった一部のアミンはアルカロイドと構造や生合成が類似しており、アルカロイドと呼ばれることがある[155]。
抽出

コショウから抽出されたピペリンの結晶。
アルカロイドの構造的多様性のため、天然素材からアルカロイドを抽出する単一の手法は存在しない[156]。ほとんどの手法は、ほとんどのアルカロイドが有機溶媒に溶解して水には不溶なのに対して、それらの塩は逆の傾向を示す特性を利用している。
ほとんどの植物は複数のアルカロイドを含んでいる。最初にそれらの混合物を抽出し、次に個別のアルカロイドを分離する[157]。植物は抽出前に徹底的に挽く[156][158]。ほとんどのアルカロイドは生植物内で有機酸との塩の形で存在しており[156]、抽出されたアルカロイドは塩のままか塩基へと変化している[157]。塩基抽出は植物材料をアルカリ溶液で処理し、1,2-ジクロロエタン、クロロホルム、ジエチルエーテル、ベンゼンといった有機溶媒にアルカロイド塩基を抽出することで達成される。次に、不純物を弱酸に溶解させる。これによってアルカロイド塩基は塩へと変換され、水によって洗い流される。もし必要ならば、アルカロイド塩の水溶液を再びアルカリ性にし、有機溶媒で処理する。この過程を所望の純度が得られるまで繰り返す。
酸抽出では、植物材料は弱酸性溶液(例: 酢酸の水溶液、エタノール溶液、メタノール溶液)で処理される。次にアルカロイドを有機溶媒で抽出できる塩基性型へと変換するために塩基が加えられる(もし抽出をアルコールを使って行う場合は、まずアルコールを除去し残渣を水に溶解する)。この溶液を上記のように精製する[156][159]。
個々のアルカロイドは、特定の溶媒に対する溶解度の差異や特定の試薬に対する反応性の差異、あるいは蒸留を用いて混合物から分離される[160]。
生合成
ほとんどのアルカロイドの生物学的前駆体はオルニチン、リジン、フェニルアラニン、チロシン、トリプトファン、ヒスチジン、アスパラギン酸、アントラニル酸といったアミノ酸である[161]。ニコチン酸はトリプトファンあるいはアスパラギン酸から合成できる。アルカロイド生合成の経路は数え切れない程あるため、容易に分類することは不可能である[70]。しかしながら、シッフ塩基の合成やマンニッヒ反応を含む様々なアルカロイドの生合成に関与する典型的な反応がいくつかある[161]。
シッフ塩基の合成
シッフ塩基は、アミンとケトンあるいはアルデヒドを反応させることで得ることができる[162]。これらの反応はC=N結合を作る一般的な方法である[163]。
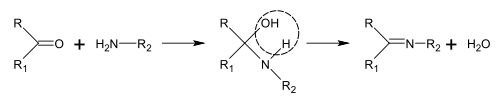
アルカロイドの生合成において、こういった反応はピペリジンの合成[26]のように分子内でも起こる[161]。

マンニッヒ反応
マンニッヒ反応の不可欠な構成要素は、アミンとカルボニル化合物に加えて、アミンとカルボニル化合物との反応で形成されるイオンに対する求核付加反応において求核剤としての役割を果たすカルバニオンである[163]。

マンニッヒ反応は分子間、分子内いずれの場合でも進行する[164][165]。

二量体アルカロイド
上述の単量体アルカロイドに加えて、単量体アルカロイドの縮合によって形成される二量体、三量体、四量体アルカロイドも存在する。二量体アルカロイドは通常同じ種類の単量体から以下の機構によって形成される[166]。
マンニッヒ反応(ボアカミン)
マイケル付加(ビラルストニン)- アルデヒトとアミンの縮合(トキシフェリン)
- フェノールの酸化的付加(ダウリシン、ツボクラリン)
ラクトン化(カルパイン)
ボアカミン

ビラルストニン

トキシフェリン

ダウリシン

ツボクラリン

カルパイン(Carpaine)
生物学的役割
アルカロイドを作る生物におけるアルカロイドの役割は未だ不明な点が多い[167]。当初は、アルカロイドは、動物における尿素のように植物における窒素代謝の最終産物であると推測されていた。後に、アルカロイドの濃度が時間とともに変動することが明らかとなり、この仮説は反証された[6]。
アルカロイドの既知の機能のほとんどは防御と関連している。例えば、ユリノキが生産するアポルフィンアルカロイドのリリオデニンは寄生性キノコから木を防御している。加えて、植物におけるアルカロイドの存在は昆虫や脊索動物の食害を妨げている。しかしながら、一部の動物はアルカロイドに適応し、自身の代謝系で利用できるものさえある[168]。セロトニン、ドーパミン、ヒスタミンといったアルカロイド関連物質は動物において重要な神経伝達物質である。アルカロイドにより植物の生長が制御できることも知られている[169]。
応用
医学分野
生薬をはじめ、アルカロイド含有植物の医学的使用には長い歴史があり、ゆえに、19世紀に最初のアルカロイドが単離された時、ただちに臨床診療における応用が見出された[170]。多くのアルカロイドはいまだに医薬品として(大抵塩の形で)利用されている。以下に例を示す[6][171]。
| アルカロイド | 作用 |
|---|---|
アジュマリン | 抗不整脈 |
アトロピン、スコポラミン、ヒオスシアミン | 抗コリン |
ビンブラスチン、ビンクリスチン | 抗腫瘍 |
ビンカミン | 血管拡張、高血圧治療 |
コデイン | 鎮咳去痰薬 |
コカイン | 麻酔薬 |
コルヒチン | 痛風の治療薬 |
モルヒネ | 鎮痛 |
レセルピン | 高血圧治療 |
ツボクラリン | 筋弛緩 |
フィゾスチグミン | アセチルコリンエステラーゼ阻害剤 |
キニジン | 抗不整脈 |
キニーネ | 解熱、抗マラリア |
エメチン | 抗原虫薬 |
麦角アルカロイド | アドレナリン作動薬、血管拡張、高血圧治療 |
多くの合成および半合成薬は、薬の主要な作用を増強あるいは変化させ、不要な副作用を低減するよう設計されたアルカロイドの構造修飾体である[172]。例えば、オピオイド受容体アンタゴニストであるナロキソンはケシに存在するテバインの誘導体である[173]。

テバイン

ナロキソン
農業
比較的低毒性の合成農薬が開発される前は、ニコチンおよびアナバシンの塩といった一部のアルカロイドが殺虫剤として使用されていた。これらの使用はヒトに対する高い毒性によって制限されていた[174]。
向精神薬としての使用
アルカロイドを含む植物の生薬やそれらの抽出物、後には純粋なアルカロイドは古くから向精神物質として使用されている。コカインおよびカチノンは中枢神経系の覚醒剤である[175][176]。メスカリンおよび(シロシビン、ジメチルトリプタミン、イボガインといった)インドールアルカロイドの多くは幻覚作用を有する[177][178]。モルヒネおよびコデインは強力な麻薬性鎮痛薬である[179]。
それ自身は強力な向精神作用を持たないが、半合成向精神薬の前駆体であるアルカロイドも存在する。例えば、エフェドリンおよびプソイドエフェドリンはメトカチノンおよびメタンフェタミンの製造に用いられる[180]。
アルカロイドの例
アコニチン(トリカブトに含まれる猛毒成分)
アトロピン(ベラドンナなどのナス科植物に含まれる猛毒成分。パーキンソン病、サリン、VXガス中毒の治療に使われる)
アリストロキア酸(ウマノスズクサ類に含まれる)
アレコリン(ビンロウに含まれる。興奮、刺激、食欲の抑制作用あり)
エフェドリン(麻黄に含まれる。鎮咳効果あり)
カフェイン(コーヒー豆、緑茶、紅茶、カカオに含まれる。中枢神経興奮作用あり)- カンプトテシン
キニーネ(キナの皮に含まれる。マラリアの特効薬として使われる)
クラーレ(アマゾンで矢毒としてつかわれた)
コカイン(コカから抽出。中枢神経興奮作用あり)
コルヒチン(痛風の特効薬)
シロシビン(シビレタケ属ヒカゲタケ属に含まれる成分)
スコポラミン(ナス科ハシリドコロなどに含まれる成分。交感神経抑制。主に乗り物酔い止め薬として使われる)
スワインソニン(アメリカホドイモの莢に含まれる成分。)
ストリキニーネ(マチンに含まれる成分)- セダクリプチン
ソラニン(ジャガイモの芽や皮に含まれる)
タキシン(イチイの果肉を除く部分に含まれる)
テオフィリン(利尿薬、気管支喘息治療薬)
テオブロミン(カカオに含まれる成分)
テトロドトキシン(フグなどが持つ猛毒成分)
トマチン(トマトの花、葉、茎、未熟果実に含まれる。トマトの害虫忌避成分。人体へは腹痛下痢等の症状)
ドーパミン(覚醒アミン)
ニコチン(タバコ草に含まれる。喫煙による摂取では人体への影響は弱いが依存症になる傾向大)- ビンカアルカロイド(ニチニチソウに含まれる10種以上のアルカロイドの総称。ビンクリスチン、ビンブラスチンなどには細胞分裂阻害作用があり抗がん剤として用いられる)
ベルベリン(キンポウゲ科オウレン、ミカン科キハダの成分。止瀉薬として使われる)
モルヒネ(アヘンより抽出されるオピオイド。中枢神経抑制、鎮痛効果あり)
リコリン(ヒガンバナ科の植物に含まれる毒・ヒガンバナ自身はガランタミンも含有)
サマンダリン(主にイモリ科のファイアサラマンダー(Salamandra salamandra)の皮脂腺に含まれる)
脚注
^ Andreas Luch (2009). Molecular, clinical and environmental toxicology. Springer. p. 20. ISBN 3-7643-8335-6. http://books.google.com/?id=MtOiLVWBn8cC&pg=PA20.
- ^ abIUPAC. Compendium of Chemical Terminology, 2nd ed. (The "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997) ISBN 0-9678550-9-8 doi:10.1351/goldbook
^ R. H. F. Manske. The Alkaloids. Chemistry and Physiology. Volume VIII. – New York: Academic Press, 1965, p. 673
^ Robert Alan Lewis. Lewis' dictionary of toxicology. CRC Press, 1998, p. 51 ISBN 1-56670-223-2
- ^ abcdChemical Encyclopedia: alkaloids
- ^ abcRobert A. Meyers Encyclopedia of Physical Science and Technology – Alkaloids, 3rd edition. ISBN 0-12-227411-3
^ Leland J. Cseke Natural Products from Plants Second Edition. – CRC, 2006, p. 30 ISBN 0-8493-2976-0
^ A. William Johnson Invitation to Organic Chemistry, Jones and Bartlett, 1999, p. 433 ISBN 0-7637-0432-6
^ Raj K Bansal A Text Book of Organic Chemistry. 4th Edition, New Age International, 2004, p. 644 ISBN 81-224-1459-1
- ^ abcdAniszewski, p. 110
^ In the penultimate sentence of his article [W. Meissner (1819) "Über Pflanzenalkalien: II. Über ein neues Pflanzenalkali (Alkaloid)" (On plant alkalis: II. On a new plant alkali (alkaloid)), Journal für Chemie und Physik, vol. 25, pp. 377–381] Meissner wrote "Überhaupt scheint es mir auch angemessen, die bis jetzt bekannten Pflanzenstoffe nicht mit dem Namen Alkalien, sondern Alkaloide zu belegen, da sie doch in manchen Eigenschaften von den Alkalien sehr abweichen, sie würden daher in dem Abschnitt der Pflanzenchemie vor den Pflanzensäuren ihre Stelle finden." (In general, it seems appropriate to me to impose on the known plant substances not the name "alkalis" but "alkaloids", since they differ greatly in some properties from the alkalis; among the chapters of plant chemistry, they would therefore find their place before plant acids [since "Alkaloid" would precede "Säure" (acid)].)
^ Hesse, pp. 1–3
- ^ abHesse, p. 5
^ 接尾辞 "ine" はギリシャ語の女性父称を作る接尾辞であり、「〜の娘」を意味する。すなわち、アトロピンは「Atropa(ベラドンナ)の娘」を意味する。[1]
^ Hesse, p. 7
- ^ abAniszewski, p. 182
^ Hesse, p. 338
^ Hesse, p. 350
^ Hesse, pp. 313–316
- ^ abTSB: Coniine
^ Hesse, p. 204
^ Begley, Natural Products in Plants
- ^ abHesse, p. 11
^ Orekhov, p. 6
^ Aniszewski, p. 109
- ^ abDewick, p. 307
^ Hesse, p. 12
- ^ abPlemenkov, p. 223
^ Aniszewski, p. 108
- ^ abcdHesse, p. 84
- ^ abcDewick, p. 381
- ^ abHesse, p. 31
- ^ abcdefghiDimitris C. Gournelif, Gregory G. Laskarisb and Robert Verpoorte (1997). “Cyclopeptide alkaloids”. Nat. Prod. Rep. 14 (1): 75–82. doi:10.1039/NP9971400075. PMID 9121730.
^ Aniszewski, p. 11
^ Plemenkov, p. 246
- ^ abAniszewski, p. 12
- ^ abDewick, p. 382
^ Hesse, pp. 44, 53
- ^ abcPlemenkov, p. 224
- ^ abcAniszewski, p. 75
^ Orekhov, p. 33
- ^ abcChemical Encyclopedia: Tropan alkaloids
^ Hesse, p. 34
^ Aniszewski, p. 27
- ^ abcdChemical Encyclopedia: Pyrrolizidine alkaloids
^ Plemenkov, p. 229
^ Blankenship JD, Houseknecht JB, Pal S, Bush LP, Grossman RB, Schardl CL (2005). “Biosynthetic precursors of fungal pyrrolizidines, the loline alkaloids”. Chembiochem 6 (6): 1016–1022. doi:10.1002/cbic.200400327. PMID 15861432.
^ Faulkner JR, Hussaini SR, Blankenship JD, Pal S, Branan BM, Grossman RB, Schardl CL (2006). “On the sequence of bond formation in loline alkaloid biosynthesis”. Chembiochem 7 (7): 1078–1088. doi:10.1002/cbic.200600066. PMID 16755627.
^ Schardl CL, Grossman RB, Nagabhyru P, Faulkner JR, Mallik UP (2007). “Loline alkaloids: currencies of mutualism”. Phytochemistry 68 (7): 980–996. doi:10.1016/j.phytochem.2007.01.010. PMID 17346759.
^ Plemenkov, p. 225
^ Aniszewski, p. 95
^ Orekhov, p. 80
- ^ abcdefChemical Encyclopedia: Quinolizidine alkaloids
^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. – London: The Chemical Society, 1971, p. 93
^ Aniszewski, p. 98
^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. – London: The Chemical Society, 1971, p. 91
^ Joseph P. Michael (2002). “Indolizidine and quinolizidine alkaloids”. Nat. Prod. Rep 19: 458–475. doi:10.1039/b208137g.
^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. – London: The Chemical Society, 1971, p. 92
^ Dewick, p. 310
^ Aniszewski, p. 96
^ Aniszewski, p. 97
- ^ abcPlemenkov, p. 227
- ^ abChemical Encyclopedia: pyridine alkaloids
- ^ abAniszewski, p. 107
- ^ abAniszewski, p. 85
^ Plemenkov, p. 228
- ^ abHesse, p. 36
- ^ abcdefghijklmnopqrstChemical Encyclopedia: isoquinoline alkaloids
^ Aniszewski, pp. 77–78
- ^ abcdBegley, Alkaloid Biosynthesis
- ^ abJ. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 3. – London: The Chemical Society, 1973, p. 122
- ^ abcHesse, p. 54
- ^ abHesse, p. 37
^ Hesse, p. 38
- ^ abcHesse, p. 46
- ^ abcHesse, p. 50
- ^ abcKenneth W. Bentley (1997). “β-Phenylethylamines and the isoquinoline alkaloids”. Nat. Prod. Rep 14 (4): 387–411. doi:10.1039/NP9971400387. PMID 9281839.
- ^ abHesse, p. 47
^ Hesse, p. 39
- ^ abHesse, p. 41
- ^ abHesse, p. 49
^ Hesse, p. 44
- ^ abcJ. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 3. – London: The Chemical Society, 1973, p. 164
- ^ abHesse, p. 51
- ^ abcPlemenkov, p. 236
^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 3. – London: The Chemical Society, 1973, p. 163
^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 3. – London: The Chemical Society, 1973, p. 168
^ Hesse, p. 52
^ Hesse, p. 53
- ^ abcdePlemenkov, p. 241
^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 35. – Academic Press, 1989, p. 261
^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 35. – Academic Press, 1989, pp. 260–263
- ^ abPlemenkov, p. 242
^ Begley, Cofactor Biosynthesis
^ John R. Lewis (2000). “Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids”. Nat. Prod. Rep 17 (1): 57–84. doi:10.1039/a809403i. PMID 10714899. http://www.rsc.org/publishing/journals/NP/article.asp?doi=a809403i.
^ Chemical Encyclopedia: Quinazoline alkaloids
^ Aniszewski, p. 106
- ^ abAniszewski, p. 105
^ Richard B. Herbert; Herbert, Richard B.; Herbert, Richard B. (1999). “The biosynthesis of plant alkaloids and nitrogenous microbial metabolites”. Nat. Prod. Rep 16: 199–208. doi:10.1039/a705734b. http://www.rsc.org/publishing/journals/NP/article.asp?doi=a705734b.
^ Plemenkov, pp. 231, 246
^ Hesse, p. 58
^ Plemenkov, p. 231
- ^ abcdChemical Encyclopedia: Quinoline alkaloids
- ^ abAniszewski, p. 114
^ Orekhov, p. 205
^ Hesse, p. 55
- ^ abPlemenkov, p. 232
^ Orekhov, p. 212
^ Aniszewski, p. 118
- ^ abAniszewski, p. 112
- ^ abcdefAniszewski, p. 113
^ Hesse, p. 15
^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. – London: The Chemical Society, 1971, p. 467
^ Dewick, p. 349-350
- ^ abcAniszewski, p. 119
^ Hesse, p. 29
^ Hesse, pp. 23–26
^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. – London: The Chemical Society, 1971, p. 169
^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 5. – London: The Chemical Society, 1975, p. 210
^ Hesse, pp. 17–18
^ Dewick, p. 357
- ^ abAniszewski, p. 104
^ Hesse, p. 72
^ Hesse, p. 73
^ Dewick, p. 396
^ PlantCyc Pathway: ephedrine biosynthesis
^ Hesse, p. 76
- ^ abChemical Encyclopedia: colchicine alkaloids
^ Aniszewski, p. 77
- ^ abHesse, p. 81
^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. – Academic Press, 1984, p. 376
- ^ abHesse, p. 77
^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. – Academic Press, 1984, p. 268
^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. – Academic Press, 1984, p. 231
- ^ abcdefHesse, p. 82
^ Spermine Biosynthesis
- ^ abcdefPlemenkov, p. 243
^ Chemical Encyclopedia: Terpenes
^ Begley, Natural Products: An Overview
^ Atta-ur-Rahman and M. Iqbal Choudhary (1997). “Diterpenoid and steroidal alkaloids”. Nat. Prod. Rep 14 (2): 191–203. doi:10.1039/np9971400191. PMID 9149410. http://www.rsc.org/publishing/journals/NP/article.asp?doi=NP9971400191.
^ Hesse, p. 88
^ Dewick, p. 388
^ Plemenkov, p. 247
^ TSB: Nicotine
- ^ abcGrinkevich, p. 131
- ^ abG. A. Spiller Caffeine, CRC Press, 1997 ISBN 0-8493-2647-8
^ Fattorusso, p. 53
^ Thomas Acamovic, Colin S. Stewart, T. W. Pennycott (2004). Poisonous plants and related toxins, Volume 2001. CABI. p. 362. ISBN 0-85199-614-0. http://books.google.com/?id=nixyqfGIGHcC&pg=PA362.
^ Fattorusso, p. XVII
^ Aniszewski, p. 13
^ Orekhov, p. 11
^ Hesse, p.4
^ Grinkevich, pp. 122–123
^ Orekhov, p. 12
^ Aniszewski, pp. 110–111
- ^ abcdHesse, p. 116
- ^ abGrinkevich, p. 132
^ Grinkevich, p. 5
^ Grinkevich, pp. 132–134
^ Grinkevich, pp. 134–136
- ^ abcPlemenkov, p. 253
^ Plemenkov, p. 254
- ^ abDewick, p. 19
^ Plemenkov, p. 255
^ Dewick, p. 305
^ Hesse, pp. 91–105
^ Aniszewski, p. 142
^ Hesse, pp. 283–291
^ Aniszewski, pp. 142–143
^ Hesse, p. 303
^ Hesse, pp. 303–309
^ Hesse, p. 309
^ Dewick, p. 335
^ György Matolcsy, Miklós Nádasy, Viktor Andriska Pesticide chemistry, Elsevier, 2002, pp. 21–22 ISBN 0-444-98903-X
^ Veselovskaya, p. 75
^ Hesse, p. 79
^ Veselovskaya, p. 136
^ Geoffrey A. Cordell The Alkaloids: Chemistry and Biology. Volume 56, Elsevier, 2001, p. 8
^ Veselovskaya, p. 6
^ Veselovskaya, pp. 51–52
参考文献
Aniszewski, Tadeusz (2007). Alkaloids – secrets of life. Amsterdam: Elsevier. ISBN 978-0-444-52736-3.
Begley, Tadhg P. (2009). Encyclopedia of Chemical Biology. Wiley. doi:10.1002/cbic.200900262. ISBN 978-0-471-75477-0.
Dewick, Paul M (2002). Medicinal Natural Products. A Biosynthetic Approach. Second Edition. Wiley. ISBN 0-471-49640-5.
Fattorusso, E. and Taglialatela-Scafati, O. (2008). Modern Alkaloids: Structure, Isolation, Synthesis and Biology. Wiley-VCH. ISBN 978-3-527-31521-5.
Grinkevich NI Safronich LN (1983). The chemical analysis of medicinal plants: Proc. allowance for pharmaceutical universities. M.
Hesse, Manfred (2002). Alkaloids: Nature's Curse or Blessing?. Wiley-VCH. ISBN 978-3-906390-24-6.
Knunyants, IL (1988). Chemical Encyclopedia. Soviet Encyclopedia. http://www.cnshb.ru/AKDiL/0048/base/RA/140004.shtm.
Orekhov, AP (1955). Chemistry alkaloids (Acad. 2 ed.). M.: USSR.
Plemenkov, VV (2001). Introduction to the Chemistry of Natural Compounds. Kazan.
関連項目
- ステロイドアルカロイド
- インドールアルカロイド
| ||||||||||||||||||||||||







